新一代环保型病理试剂的应用(HE、IHC和CISH)评估与体会
新一代环保型病理试剂的应用(HE、IHC和CISH)
评估与体会
倪灿荣 张顺民
第二军医大学长海医院病理科
摘自:2011年03期《诊断病理学杂志》
常规病理技术的脱水石蜡包埋、HE染色的建立已有一百多年的历史,一直沿用至今。其石蜡切片制作和染色方法中使用的甲醛和二甲苯存在着对职业工作环境和排放后对生活环境的***害和污染,危害人类的生存环境,为此,全球的病理工作者,在积极努力地寻找甲醛和二甲苯的替代产品,其间有不少改进和替代方法的文献报道,但应用后均不够理想,未能得到推广应用[1~13]。
本文着重介绍应用GS标本套装试剂制备的石蜡组织切片进行HE染色、免疫组织化学染色(46种抗体)、免疫荧光组化双重标记和原位杂交-CISH检测HER2基因的效果比较。
1. 材料和方法
1.1 材料
300例人体组织标本包括乳腺癌、前列腺癌、肾癌、子宫肌瘤、宫颈癌、卵巢癌、胃癌、结肠癌、肺癌和肝癌,以及二例尸检各脏器等组织均为长海医院手术标本和尸体解剖标本。200例荷瘤大鼠、小鼠、荷瘤裸小鼠;100例***、兔和羊等实验动物组织的脑、骨、胃、肠、肺、食管、肝、脾、肾、胆、胰、子宫、卵巢、心脏、血管、脊髓、神经和皮肤等组织样本,标准取材并按GS组织固定脱水系列套装实际说明书操作流程进行后固定、脱水、透明和包埋。
1.2 试剂
(1)GS组织样本制备套液及GS病理切片染色套液(内含无醛组织固定液,环保脱水、透明、浸蜡液,HE染色液和脱蜡、透明、封片胶)为哈尔滨格林标本技术开发有限公司研制并生产;(2)特异性一抗来源、稀释度见表1,多聚物酶UIP/HRP购置于日本N-Histofine公司,Code414154F[14]、S-P法主要针对羊来源一抗,购置于美国Sigma公司,羊抗兔LgG-FITC1:200和羊抗鼠LgG-Cy3 1:200购置于美国Sigma公司,Dig标记HPV Kit购置于福州泰普生物科学有限公司(批号:32090601),Dig标记HBV探讨本实验室制备,CISH-HER2 Kit购置于美国invtrongen公司(批号:84-0150),Tunel kit(Dig标记/HRP-DAB)购置于美国CHEMICON公司(批号:VR1362694)。
1.3 方法
(1)组织固定、脱水、透明和包埋本文应用GS组织固定脱水系列套装试剂,标准取材后按GS组织固定脱水系列套装试剂说明书操作流程进行流程进行后固定、脱水、透明和包埋。其流程如下: 组织固定剂固定60~120min;2 组织脱水剂160~90min;组织脱水剂||60~90min; 组织透明剂60~120min; 浸蜡130~60min;浸蜡|| 30~60min; 浸蜡||30~60min,包埋。(2)HE染色石蜡切片用GS无苯脱蜡液脱蜡至水(脱蜡 石蜡切片用脱蜡液|、脱蜡液||、脱蜡液|||各5min,苏木素染色2min,自来水洗10s,用盐酸水溶液1:2000分化3s,自流水冲洗2~5min:2 伊红染色中染1~3min,自来水洗3s,除浮染液3s,沥干残余试剂或用电吹风吹干,进入除水透明液1-2min,进入透明液2min,***后沥干封片。(3)免疫组织化学UIP法与S-P法、免疫荧光组织化学单染和双标染色、Tunel法和原位杂交:Dig标记HPV和HBV探针操作流程参阅相关文献[14],CISH-HER2操作流程参阅相关文献[15-16],Tunel法操作流程参考相关文献[14,17]。
2.结果
2.1 脱水、透明、浸蜡包埋与HE染色
应用G S组织固定脱水系列套装试剂进行固定、脱水、透明、浸蜡和包埋,并按GS染色系列套装试剂进行HE染色。结果包埋后的组织块可以顺利的切至3μm的石蜡切片,无苯型脱蜡剂在室温下2×5min完成石蜡切片脱蜡(免疫组化染色建议3×5脱蜡)。苏木素染色液和伊红染色液的染色力强,颜色鲜艳(图1-2),染色系列试剂中的GS无苯型封片胶透明度及封片效果良好,可以替代以传统二甲苯为溶剂的封片胶封固切片,减少室内的***害气体污染。
2.2 免疫组织化学
利用人结肠癌、胃癌、肾癌、肺癌、脑胶质瘤、乳腺癌和前列腺癌等组织;动物***、兔、大鼠和小鼠肺、脾、肝、脑和胰腺等组织,分别检测46种不同抗原(所用一抗来源、稀释度、种属特异性详见表1),免疫组织化学采用多聚物酶UIP法[14]、S-P法主要针对羊来源一抗[14]、以及免疫荧光双标记法[14]。IHC检测结果显示,其阳性检测率和阳性强度均与常规乙醇脱水、二甲苯透明效果基本一致(图3-4)。
|
序号 |
抗体名称 |
种族 |
交叉反应 |
批号 |
稀释度 |
检测组织 |
购置公司 |
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 |
大鼠CD31 大鼠CD31 SHP1 CD133 NPY MFN2 Collage I GL1-1 Foxp3 Foxp3 EpCam CD44 TLR4 SNCG AcidGlycoprotein ADAM10 TGFβR1 MFN2 Nephrin Neph 1 Podocin CD2AP PTEN OCT3/4 OCT4 IGF1R NK-1 THRα2 S100A4 Collage I Pan-CK Ki-67 COX2 HER2 Cyclin D1 CK19 CK20 HCK D2-40 EGFR HMGP1 Amylase Troponin T-C HO-1 IL1β IL17 |
M Rat 兔McAb 兔 兔 McAb 羊 兔 鼠McAb 兔 鼠McAb 兔McAb 兔 羊 兔 兔 兔 鼠 兔 羊 兔 羊 鼠McAb 鼠McAb 鼠McAb 兔 兔 鼠McAb 兔 兔 鼠McAb 鼠McAb 鼠McAb 鼠McAb 鼠McAb 鼠McAb 鼠McAb 鼠McAb 鼠McAb 鼠McAb 鼠McAb 兔 羊 兔 兔 兔 |
M M 人/M 人/M/rat 人/M/rat 人/M/rat 人/M/rat 人/M/rat 人 人/M/rat 人 人 h/m/r 人 人 人 h/m/r h/m/r h/m/r h/m/r h/m/r h/m/r 人 人/M 人 人 人 人 人/M/R 人/m/r 人 人 人 人 人 人 人 人 人 人 人 M/R h/m/r 人 人 h/m/r |
MAB1393 CBL1337 ab32559 ab16518 N9528 H00009927-M01 SC-60287 Sc-20687 Ab20034 Sc-28705 Ab23566 Ab51037 Sc-10741 Sc-10698 Ab18515 Ab1997 Sc-402 Sc-100560 Sc-281921 Sc-27970 Sc-21009 SC-8763 Sc-56205 SC-5279 Ab49091 ab54274 NB10074469 Ab30582 Ab27957 Ab29285 M3515 M7240 COX229 EP1045Y SP4 EP1580Y EPR1624Y 34Βe12 D2-40 EP774Y MAB1690 D55H10 Sc-8121 Ab79854 NB600-633 SC-7927 |
1:20 1:20 1:100 1:50 1:1000 1:300 1:100 1:100 1:100 1:75 1:50 1:500 1:200 1:100 1:100 1:500 1:80 1:300 1:50 1:50 1:100 1:200 1:100 1:400 1:300 1:2000 1:1000 1:200 1:400 1:200 1:100 1:100 1:50 1:100 1:50 1:100 1:200 1:200 1:80 1:50 1:200 1:50 1:100 1:200 1:100 1:100 |
大鼠 小鼠 人肺 小鼠脑 小鼠肠 人肺 ******肤 大鼠 人肝肾 大鼠 人肝 人肿瘤 人肿瘤 人肝、肺 人肝、肺 人脑 鼠肝、肺 人鼠心肌 鼠肝 鼠肝肾 人肾 人肾 人肺癌 人肿瘤人肿研 人骨 人 人 大鼠肝 大鼠肝 人肿瘤 人肿瘤 人肿瘤 人肿瘤 人肿瘤 人肿瘤 人肿瘤 人肿瘤 人肿瘤 人肿瘤 人肿瘤 鼠胰 人肺癌 人肺癌 人肿瘤 |
Milipore Milipore Abcam Abcam Cell signaling Abnova Santa cruz Santa cruz Santa cruz Santa cruz Abcam Abcam Santa cruz Santa cruz Abcam Abcam Santa cruz Santa cruz Santa cruz Santa cruz Santa cruz Santa cruz Santa cruz Santa cruz Abcam Abcam Novus Abcam Abcam Abcam DAKO DAKO 太阳公司 太阳公司 太阳公司 太阳公司 太阳公司 太阳公司 太阳公司 太阳公司 R&D Cell signaling Santa cruz Abcam |
2.3 原位杂交
应用ISH-HBV检测5例HBV阳性肝癌标本结果100%阳性(5/5);ISH-HPV16/18探针检测5例宫颈癌标本,结果阳性检测率为60%(3/5);,原位杂交CISH法检测10例乳腺癌HER2原癌基因,结果阳性检测率为60%(6/10;低扩增3例,高扩增3例),其阳性检测率和阳性强度与常规乙醇脱水、二甲苯透明基本一致(图5- )。
2.4 Tunel法
检测10例大鼠实验模型肝组织分别用GS环保试剂和常规脱水透明石蜡切片。均用格林脱蜡液脱蜡至水,Tunel法染色,结果凋亡指数检测率基本一致(图5-)。
3.讨论
常规甲醛固定、乙醇脱水、二甲苯透明、石蜡包埋的石蜡切片和HE染色技术创立已100多年,是一个良好的组织病理学技术方法。但是以今天的眼光来看,传统石蜡切片制作和染色方法中使用的甲醛和二甲苯存在着对职业工作环境和排放后对生活环境的***害和污染。因此,减少或完全替代甲醛和苯系化学***害试剂的使用,建立一套替代技术取代石蜡包埋切片技术中上述***害试剂的使用是一项意义重大的工作。近十年来,国内外相继推出了数种甲醛和二甲苯的替代品,这些产品或因功能单一不成系统、或因效能不高达不到技术要求、或因价格较高不利普及[1-13]。尤其是国内很少有厂家研发和推出类似相对环保的系列病理试剂。
由哈尔滨格林标本技术开发有限公司推出的GS组织固定脱水系列套装试剂和HE染色系列套装试剂是国内******个专业厂家推出的******套相对环保型套装系列试剂。二年前经北京同行的介绍。开始验证性使用该产品[18-20],应用该公司GS无醛及无二甲苯全程处理液制备30000余例人体各组织标本和100例***、兔和羊等实验动物组织的各种器官的石蜡包埋切片与常规石蜡切片验证性比较试验,并从HE染色的形态结构观察,免疫组织化学染色(46种抗体)抗原表达状况、免疫荧光组化双重标记和原位杂交(HPV、HBV和HER2基因探针)DNA的影响程度等多方面比较。结果GS无醛及无二甲苯全程处理液制备的石蜡切片软硬适中,切片厚薄均匀,连续性好。常规HE染色细胞形态完整清晰,苏木素伊红染色鲜艳,对比分明。组织脱水到包埋仅需6小时,比常规12小时大大缩短。常规HE染色过程中主要的污染源来自二甲苯,GS切片染色技术不仅杜绝了二甲苯对人体的伤害,而且常规染色时间45min,GS切片染色时间为13min,染色时间缩短,染色效果符合诊断要求,个别切片因染色时间稍长一点,太鲜艳也会造成视觉上的影响。
为了验证GS无醛及无二甲苯全程处理液组织包埋切片对IHC和分子杂交DNA检测的影响程度,我们初步选用100例人体肿瘤标本和50例实验动物模型,选用多聚物UIP法、S-P法和免疫荧光组织化学双重标记方法,分别检测46种不同******抗体,结果阳性检测率和阳性强度与常规石蜡切片基本一致,说明该GS无醛及无二甲苯全程组织处理液包埋的石蜡切片可用于日常的免疫组化标记和鉴别诊断。ISH也检测了5例宫颈癌中的HPV,5例肝癌中的HBV和10例乳腺癌中的HER2基因结果也与常规石蜡切片基本一致。
经上述实际技术测试结果显示:GS系列试剂完全可以替代传统的以甲醛二甲苯为主体的石蜡切片技术流程,减少室内有***有害气体的污染和***害作用同时杜绝大量排放此类***害化学物质对生活环境的污染,期望广大病理技术的同道们积极地参与到类似新型环保试剂的应用和技术实践中来,为此类新型环保型试剂技术性能的提高和不断完善提供更加充分祥实的技术信息和使用经验。
图板说明:



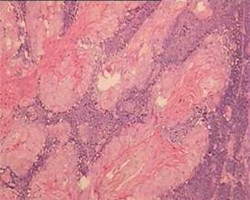
图1.使用GS组织固定脱水和HE染色系列套装试剂行***、兔和大鼠骨关节HE染色
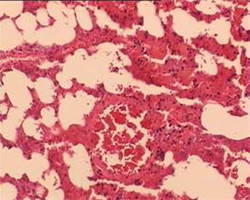
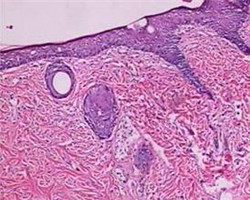

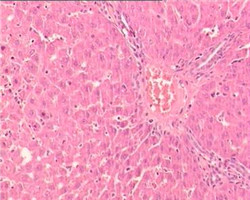
图2.使用GS组织固定脱水和HE染色系列套装试剂行大鼠肺、皮肤、肿瘤和肝HE染色






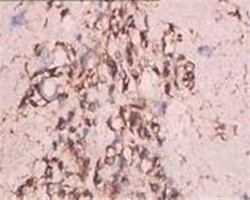
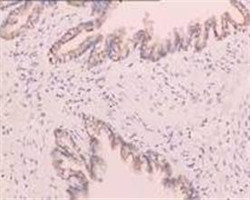
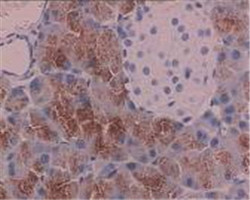
图3.使用GS组织固定脱水、透明系列套装试剂包埋的动物组织IHC检测结果:小鼠肿瘤模型OCT4;大鼠肝Foxp3;大鼠肝F4-80;大鼠肝Ki67; 大鼠肝TGFβR1;大鼠脑GFAP;大鼠脑Nestin;小鼠肺||1β;大鼠胰腺AmyIase。


图4.使用GS的组织固定脱水、透明系列套装试剂包埋的人体组织IHC检测结果:人结肠癌Pan-CK;人肺癌Septin9;胆囊癌HER2;人肿瘤Puma; 人乳腺癌HER2;人乳腺癌ER;霍奇金细胞CD30;腺癌细胞Topo|| a胶质瘤Ki67-红/Nestin-绿免疫荧光双标记。


图5.使用G S组织固定脱水、透明系列套装试剂包埋的组织ISH和Tunel检测结果:
1宫颈ISH-HPV;2乳腺癌CISH-HER2;3乳腺癌CISH-HER2 4肝穿ISH-HBV 5 肝癌ISH-HBV 6大鼠肝Tunel(从左到右)。
参考文献:
[1] Majewski P , Pernak A,lawski AG,et al. Ionic liquids in embalming and tissue preservation.Can traditional formalin-fixation be replaced safely? Acta histochemica. acta histochem. 2003,105(2):135~142.
[2] Buesa RJ. Histology safety: now and then, Ann Diag Pathol 2007,11(5):334~339
[3] Acton A,Harvey T,Grow MW.An examination of non-formalin based fixation methods for Xenopus embryos.Developm Dynam 2005,233:1464~1469.
[4] Werner M,Chott A,Fabiano A et al.Effect of formalin fixation and processing in immunohistochemistry.Ann J Surg Pathol 2000,24(7):1016~1019.
[5] Gillespie JW,Beat CJM,Bichsel VE et al.Evaluation of non-formalin tissue fixation for molecular profiling studies.Am J Pathol 2002,160 (2):449~457.
[6] Warmington AR,Wilkinson JM,Riley CB. Evaluation of ethanol-based fixatives as a substitute for formalin in diagnostic clinical laboratories.J Histotech 2000,23(4):299~308.
[7] Delfour C,Roger P,Bret C,et al.RCL2, a new fixative, preserves morphology and nucleic acid integrity in paraffin-embedded breast carcinoma and microdissected breast tumor cells.J Mol Diag 2006,8(2):157~169.
[8] Cox ML,Scharay CL,Luster CN, et al.Assessment of fixatives,fixation,and tissue processing on morphology and RNA integrity.Exp Mol Pathol 2006,80:183~191.
[9] M. Shibutami M,Uneyama C,Miyazaki K,et al.Methacarn fixation:a novel tool for analysis of gene expressions in paraffin-embedded tissue specimens, Lab Invest 2000,80:199~208.
[10] Srinivasan M,Sednak D,Jewell S.Effect of fixatives and tissue processing on the content and integrity of nucleic acids, Am J Pathol 2002,161(6):1961~1971.
[11] Dapson RW.Glyoxal fixation: how it works and why it only occasionally needs antigen retrieval, Biotech Histochem 2007,82(3):161~166.
[12] Selvarajan S,Bay BH,Choo A, et al.Effect of fixation period on HER2/neu gene amplification detected by fluorescence in situ hybridization in invasive breast carcinoma.J Histochem 2002,50(12):1 693~1696.
[13] Buesa RJ. Histology without formalin? Annals of Diagnostic Pathology 2008,12:387~396.
[14] 倪灿荣,马大烈,戴益民主编.免疫组织化学实验技术及应用.北京:化学工业出版社,2006:76-78,81-82,119-122,206-210.
[15] Gupta D, Middleton LP, Whitaker MJ et al. Comparison of fluorescence and chromogenic in situ hybridization for detection of HER-2/neu oncogene in breast cancer[J ]. Am J Clin Pathol 2003,119:381–387.
[16] 倪灿荣,白辰光.乳腺癌HER2基因扩增检测方法---显色原位杂交方法的应用及优化.第二军医大学学报[J].2008,29(1):99-102.
[17] Pearce-Kelling SE,Cideciyan AV,Aleman TS, et al. Immunocytochemical and TUNEL Staining Changes Following Light Exposure in the T4R RHO Mutant Dog.Invest Ophthalmol Vis Sci 2005,46:1662.
[18] 董建强,王德田.格林标本—新一代环保型病理组织标本固定脱水透明试剂试用报告.2010年北京市病理技术年会会编,2010:125~129.
[19] 谢永强,刘秀云,沈贵华,等.无醛固定液在病理技术工作中的应用.2010年北京市病理技术年会会编,2010:117~119.
[20] 张海峰,袁燕玲,鲁海珍,等.GS病理染色套液在常规病理制片中的作用.2010年北京市病理技术年会会编,2010:120~121.|
|
|||
|
|
|||
下载地址:

 登陆会员
登陆会员 注册会员
注册会员


 下载中心
下载中心
 病理论坛在线咨询
病理论坛在线咨询